
(图片来源:LUIS ROBAYO/AFP/GettyImages)
【看中国2017年12月6日讯】 医保的控费问题最近搞得医疗圈鸡飞狗跳,四川和贵州相继出台严厉的控费要求和问责制度。控费未达标,医院降级,院长撤职,医务人员扣工资。
可以想见,医保控费压力绝非仅仅存在于四川和贵州。这种压力应该是全国性的。但是,把控费压力一刀切的踢给一线医院和医生,似乎并不是公正的做法。医保目录的调控和药品的审批管理,都不是一线医院和医生能承担的责任。不仅如此,除非管理部门出面组织,普通一线医生也没有能力对药物做系统全面的再评价。
其实,在主管部门批准的国家医保目录和地方医保目录中,不乏一些中国特色的“灵药”。这些药物的疗效和安全性高度可疑,却每年耗费大量的医保资金。我们的主管部门在以雷厉风行的手段逼迫一线医院和医生控费的同时,是不是应该认真反思一下:这些药物是如何进入国家和地方医保目录的?以及,这些药物的生产许可为什么至今没有撤销?
下面,阿宝冒着被集体追杀的危险,说几款年销量几十亿上百亿的“灵药”。
一、单唾液酸四己糖神经节苷脂
2017年10月15日,一则新闻引起了轰动:杭州发往四川的“救命药”未能及时送达。当事人质问快递公司:人没了药还在路上,谁应该负责?
这本来是一个快递行业送药不及时延误病患用药的新闻,但在继发引起的讨论中,该药是不是救命药成为敏锐的医药专业人士的讨论焦点,业内人士几乎一边倒的指出该药:仅是辅助用药,与救命毫无关系。
出于好奇,阿宝对这个药做了一些功课。结果令人目瞪口呆。
首先,此药好生了得,在2016年国内等级医院生物制品销售额排行中名列第一,销售额突破百亿元,占生物制品药品整体销售额的十分之一,超过著名的救命药物人血白蛋白!
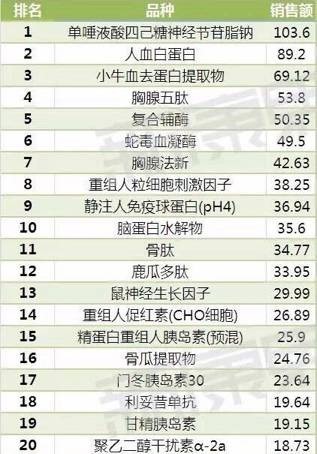
2016年国内等级医院生物制品销售额品种TOP排行(单位:亿元)(图片来源:网络)
这个“灵药”在中国如此流行,想必是疗效奇佳风靡全世界了?
笔者的好奇心来了,查阅了全世界主流药品监管部门网站。结果发现:欧美日等各国均没有批准这个药品上市,只有国外只有一个叫TrbPharma的企业在巴西和阿根廷注册了该药。
这种药物在中国最初使用,是来自进口。因其当时批准的适应症极其广泛,在医院大量使用,销量惊人增长,引发国内数十家企业仿制,甚至超过真正的救命药人血白蛋白,成为销售第一的生物药品,中国的销量占该药全球销量的99%以上。
2017年6月2日国家药监局对进口到中国的巴西和阿根廷的生产企业进行了核查,发现其生产工艺与注册工艺不一致,存在重大质量安全风险,涉嫌违反《中华人民共和国药品管理法》及其实施条例等法律法规规定,为保证公众用药安全,决定自即日起,在中国境内暂停销售使用该产品,各口岸食品药品监督管理局暂停发放该产品的进口通关凭证,并组织依法处理。见《总局关于暂停销售使用单唾液酸四己糖神经节苷脂钠注射液的公告(2017年第69号)》。
不仅如此,从去年该药频频出现在国家食药监总局网站上,国内生产药品和进口药品的都被要求修改说明书《总局关于修订单唾液酸四己糖神经节苷脂钠注射剂说明书的公告(2016年第172号)》。
总结一下:
1、全世界范围内,该药仅仅在中国和巴西阿根廷上市。
2、该药在中国生物制品排行榜雄踞第一,销售额过百亿。
3、中国销量占该药总销量99%以上。
4、该药原研药物已经因为存在重大安全风险停止进口。
由于政府的背书和企业的宣传,很多医生对其疗效深信不疑,甚至让患者家属千里迢迢从杭州往四川送药。
目前,该药在全国17个省的医保目录上。
《2016年国内等级医院生物制品销售额排行榜》靠前的还有几个“灵药”,均有共同的特点,辅助用药,价格高,国外已经淘汰或主要国家从未上市,这些药包括,蛇毒血凝酶、小牛血去蛋白提取物、脑蛋白水解物都是销量几十亿元的重磅品种,我们来看看这些药在国内外的“天壤之别”药物的庐山真面目。
二、蛇毒血凝酶
“立芷雪”是最早的蛇毒类止血药,是由瑞士素高药厂生产,来源于巴西矛头蝮蛇蛇毒提取物。
二十多年前,蛇毒血凝酶曾在法国、意大利等8个国家上市,但在随后的十多年中,被淘汰陆续退市,在“立芷雪”的原产国瑞士没有上市。
立芷雪在我国进口批件已经于2010年2月到期,素高药厂于2011年3月、5月和9月再提起注册申请,均被国家食药监总局驳回,早已正式退出中国市场,驳回的理由是:1、资料显示,本品未在生产国上市。2、本品2005年再注册批件中,明确要求申请人在本品中国临床使用期间,请进一步验证其疗效和安全性,请组织开展多中心、大样本的随机双盲对照试验,以进一步证实其临床疗效,规范说明书内容(包括适应症),为下次再注册提供再评价的依据。此次提交的临床试验结果中没有充分数据说明本品用于预防出血的有效性,且存在潜在的静脉血栓形成的风险。
随后,瑞士素高药厂不服国家药监局禁止其进口的决定向北京市中级人民法院提起诉讼,要求继续审批进口血凝酶,但被北京市人民法院驳回,法院支持了国家药监局停止进口的结果。
蛇毒血凝酶,这种药物甚至未在其原研国家瑞士上市。然而国内以此为标杆的仿制品(类似物)销售额七十多亿,此类药物主要有四个。尽管四个药的蛇毒来源不尽相同(包括其中之一号称一类药),但其在上市前的临床试验,均对比的是“立芷雪”,结论都是和其疗效相当。
“立芷雪”因疗效不确定被药监局的否定意味着国内仿制品的上市前临床试验参照物和参照标准合法不存在了,因此原有的临床试验数据失去意义,换言之是疗效相当不确切,按照常规惯例,国外的原研药品一旦因为疗效不确切或安全性风险被撤市,则其仿制品必须被相应撤市。在国外位数不多的几个国家被一一撤市时,我们国家对仿制品并没有采取行动,最后在素高药厂最后一个销售国—中国停止其进口时,中国药监部门仍然没有要求仿制品随之撤市,甚至连要求其进行临床再评价也没有,实在让人百思不得其解。
是不是蛇毒血凝酶疗效很确切并没有安全性风险呢,然而并不是,2013年,国家药监局在其网站上要求蛇毒血凝酶修改其说明书,删去原说明书中“本品具有止血功效,不影响血液中凝血酶含量,故不会导致血栓形成”的相关文字;删去原说明书中“虽无关于血栓的报道,为安全起见”的相关文字;增加“有血栓形成风险患者慎用”增加“上市后不良反应监测收集到以下不良事件:过敏性休克……等众多不良反应”。
在全球各国淘汰蛇毒血凝酶的同时,药监局虽然也禁止了蛇毒血凝酶的进口,却忘记了的中国还有仿制的的蛇毒血凝酶,成了全球停用后的孤岛。
该药目前在国家医保目录中,属于乙类药品。
三、小牛血去蛋白提取物
除中国外,仅在奥地利、德国和俄罗斯上市,原研药为奈科明公司(2011年被日本武田制药收购)生产的“爱维治”。
小牛血去蛋白提取物属辅助用药,适用于多种症状,单价高、利润空间大。目前,国内企业占全球市场份额的95%。
2015年,国内生产该药品的一家企业被查处,此后多家企业在检查中也发现问题,被认为该类产品存在系统性风险和安全隐患。
在《国家食品药品监督管理总局关于武汉华龙生物制药有限公司违法生产小牛血去蛋白提取物注射液的通告(2015年第21号)》中规定:生化药品原料多来源于动物组织,成分复杂,生产工艺及质量控制要求高,注射剂属高风险产品,必须严格按照批准的工艺生产。各省(区、市)食品药品监督管理局要加强对本行政区域内生化药品生产企业的监督检查。对发现的质量问题要及时采取有效措施控制风险;对擅自改变工艺、外购提取物等违法违规行为,要坚决依法严厉查处。
小牛血类药品也是地标升国标的产品,其有效性评价差距很大,不良反应较多较重。CFDA的数据来看,2014年共收到小牛血类药品产品不良反应1274例,其中严重不良反应56例,占4.4%。
目前,该药在全国28个省的医保目录中。
四、脑蛋白水解物
除中国外,仅在原研国奥地利上市。
早在2008年,CFDA就发布《关于加强脑蛋白水解物注射液监督检查的通知(国食药监办〔2008〕734号)》规定,脑蛋白水解物注射液在产品质量方面存在的安全风险,建议脑蛋白水解物注射液生产企业主动停止该品种的生产,并按相关技术要求,组织开展改进工艺和质量控制方法的研究工作。在相关工艺改进和质量标准未经批准前,暂不宜恢复生产。
之后,去年两个公告《总局关于修订脑蛋白水解物注射剂说明书的公告(2016年第173号)》《关于停止进口脑蛋白水解物注射液等4个药品的公告(2016年第13号)》,指出奥地利艾威特药品有限公司(EVER NeuroPharma GmbH)的脑蛋白水解物注射液(商品名:施普善)实际生产工艺与注册工艺不一致,实际处方中添加的15种氨基酸未在注册资料中体现,不符合《药品生产质量管理规范》第一百八十四条的要求,违反了《中华人民共和国药品管理法》第九条、《药品注册管理办法》第八十四条第二款的规定,停止了该药品的进口。
目前,该药在全国27个省的医保目录中。
以上四个药共同特点:
一、多来源于动物组织,成分复杂,属于高风险类药品。
二、这些药虽然是曾经有过进口,但均未在国际主流市场上市销售,或仅有极少量使用,中国基本是唯一使用销售的国家,同时还销售火爆。且普遍上了国家或者地方医保目录。
三、这些药品普遍存在疗效不确切和不良反应严重的问题,药品监管部门专门发过文件整治。
四、在各地各医院为了落实临床路径、加强合理用药、有效控制医药费用不合理增长、降低药占比,都会制定相关重点药品监控目录时,这些药基本无一落网,进入控制目录名单。
五、因为这类药品的种种乱象,今年初,CFDA划定的2017年6项药品监管重点工作中,其中一项就是,在药品生产环节,继续做好多组分生化药的整治工作,重点查处和打击生产过程中的擅自改工艺、非法添加、数据造假等违法行为,对数据不可溯源、不真实的要严肃处理。
2017年10月9日中办国办印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》其中明确了要加快推进仿制药质量和疗效一致性评价,开展药品注射剂再评价。根据药品科学进步情况,对已上市药品注射剂进行再评价,力争用5至10年左右时间基本完成。
上述这些药品已经被国外淘汰或者基本淘汰,其所谓的原研药已经消失,只剩下中国的遗腹子怪胎。所谓皮之不存毛将焉附,这些药品还有存在的法理和必要吗?
我认为,这些药物的一致性评价不应等到5-10年后,甚至也不用一致性评价,应该先行一致性淘汰,待其证明其安全有效质量可控后再恢复上市。
而这些“灵药”为什么能生存至今,且堂而皇之的上了国家和地方医保目录,每年耗费大量的医保资金,这背后的故事,也值得关注。
这些“灵药”绝非个别,很多中药注射液,也属于“灵药”级别,每年耗费大量国家医保资金。篇幅有限,就不展开讨论了。
